Bir çözeltinin H+ iyon derişimini artıran bileşikler asit olarak adlandırılır. Örneğin, suya HCl (hidroklorik asit) eklenirse 
şeklinde çözünür. Bu reaksiyon sonucu sudaki (H3O)+ derişimi artmıştır. O hâlde HCl asittir.
Bir çözeltideki H+ iyon derişimini azaltan ya da OH– iyon derişimini artıran maddelere ise baz denir. Örneğin, suya NH3 (amonyak) eklenirse 
şeklinde çözünür. Sudaki OH– derişimi artmıştır. O hâlde NH3 bazdır.
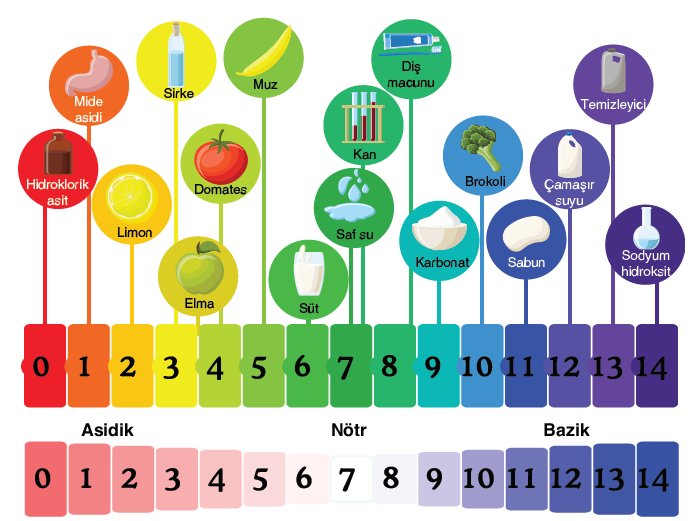
Bir çözeltinin asitliğini ve bazlığını içindeki H+ ve OH– iyon derişimleri belirler. Çözeltilerin asit ve bazlığını ölçmek için pH cetveli kullanılır. (Görsel 1.42) Bu cetvelde 0-7 arası değerler asit, 7-14 arası değerler baz, 7 ise çözeltinin nötr olduğunu gösterir.
- Çözeltideki H+ = OH– ise çözelti nötrdür. pH = 7’dir.
- Çözeltideki H+ > OH– ise çözelti asidiktir. pH < 7’dir.
- Çözeltideki H+ < OH– ise çözelti baziktir. pH > 7’dir.
- Canlılarda bulunan biyolojik sıvıların görevlerini en iyi şekilde gerçekleştirdikleri belirli pH değerleri vardır. Örneğin, kanın pH değeri 7,4’tür. Bu değer 7,1’in altına düşerse veya 7,5’in üzerine çıkarsa hayati tehlikeler oluşur. Kanımızda bulunan tampon maddeler kanın pH değerini 7,4’te tutar. Örneğin
- Toprakta elementlerin bileşik hâline dönüşmeden serbest kalmasında pH önemli etkenlerden biridir. Örneğin, kireçli topraklarda pH değerinin yüksek olması, bitkinin topraktan yeteri kadar demir, bor gibi elementleri alamamasına neden olur ve bitki sararıp ölür.
| BİLİYOR MUSUNUZ? |
| Tampon maddeler, H+ aşırı miktarda ise fazla H+ iyonlarını yok ederek veya H+ iyonları az ise eksik H+ iyonlarını çözeltiye vererek pH değişikliklerini en aza indiren kimyasallardır. |